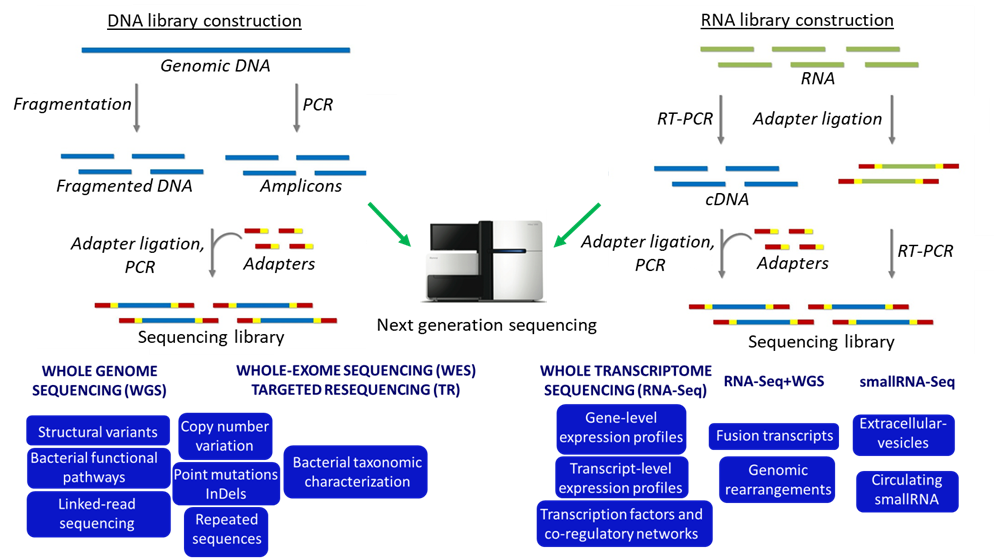
TEMATICHE DI RICERCA
Il risequenziamento del DNA abbinato all’arricchimento di regioni target è stato applicato allo studio di Neurofibromatosi, Sindrome di Noonan e Sindrome di Brugada. Questo approccio è stato esteso anche all’analisi dell’intero esoma, dove è localizzata la maggior parte delle mutazioni associate a patologie. Il sequenziamento a singola cellula è stato applicato alla caratterizzazione del trascrittoma in topi affetti da epilessia cronica, causata da una mutazione nel gene Arx.
Il risequenziamento del DNA combinato con la cattura di regioni target è stato utilizzato per lo studio della Sclerosi Laterale Amiotrofica (SLA) e della Sclerosi Multipla (SM). Il sequenziamento dell’intero genoma di 70 individui SLA, è stato applicato all’analisi sistematica di regioni ripetute. Il risequenziamento di regioni target derivanti da precedenti studi GWAS è stato impiegato per investigare varianti causali in 588 pazienti SM e 408 controlli sani.
Lo studio della Genomica nei tumori mira ad identificare nuovi marcatori utili per applicazioni di medicina personalizzata. L’uso di tecnologie massive come l’NGS e i microarray permette la caratterizzazione completa di varianti a singolo nucleotide e riarrangiamenti cromosomici, la valutazione dell’espressione di geni codificanti e non, l’identificazione di trascritti particolari, quali trascritti di fusione e RNA circolari, fino all’analisi dei microRNA nelle vescicole extracellulari circolanti rilasciate dalle cellule tumorali.
L’approccio genome-wide viene utilizzato per l’identificazione, di varianti genetiche germinali associate a alla risposta, intesa in termini di efficacia e/o tossicità, a diversi tipi di farmaci (oppioidi per il dolore da cancro, immune checkpoint inhibitors, terapie antifumo). Questi studi hanno il fine ultimo di stratificare i pazienti in base alle proprie caratteristiche costitutive, consentendo un trattamento farmacologico il più possibile personalizzato
La plasticità genomica si manifesta mediante alterazioni strutturali come duplicazioni e delezioni (plasticità 1D) oppure variazioni del posizionamento dei domini cromosomici nel nucleo (plasticità 3D). Molteplici tecnologie basate sul sequenziamento permettono di studiare questa plasticità, dalla caratterizzazione di varianti strutturali e studio delle conseguenze funzionali, sia nell’evoluzione del genoma umano sia nelle malattie germinali, all’analisi dell’architettura nucleare durante il differenziamento.
Lo studio del microbioma umano, mediante l’analisi della composizione e della struttura tramite sequenziamento degli ampliconi del gene 16S e dell’intero genoma, viene applicato in diversi contesti: nello stato di salute e in stati patologici; negli studi di adattamento a diverse diete e stili di vita; nella caratterizzazione del microbioma intestinale in volontari sottoposti a particolari stili di vita; durante infezioni e cambiamenti associati a trattamenti con probiotici.
Lo studio del genoma procariotico è orientato principalmente all’identificazione di siti di legame dei fattori di trascrizione (analisi ChIP-Seq) e all’identificazione di alterazioni genomiche tra ceppi conosciuti e non. Una pipeline per analisi di dati RNA-seq è stata ottimizzata in base alle peculiarità degli organismi procarioti e applicata a esperimenti di time-course e confronti multipli delle condizioni di crescita in molteplici microrganismi.
STAFF

Roberta Bordoni
Ricercatore

Tania Camboni
Assegnista

Camilla Ceccarani
Assegnista

Ingrid Cifola
Ricercatore

Francesca Colombo
Ricercatore

Clarissa Consolandi
Ricercatore

Gianluca De Bellis
Dirigente

Giuliana Giannuzzi
Ricercatore

Eleonora Mangano
Ricercatore

Eva Pinatel
Ricercatore

Marco Severgnini
Ricercatore